Bảng yếu tắc chất hóa học lớp 7 là tư liệu vô nằm trong hữu ích, chỉ dẫn những em học viên biết phương pháp gọi thương hiệu những yếu tắc chất hóa học theo gót danh pháp quốc tế (IUPAC). Bảng yếu tắc chất hóa học liệt kê những yếu tắc chất hóa học trở nên dạng bảng, dựa vào số hiệu nguyên vẹn tử (số proton nhập phân tử nhân), thông số kỹ thuật electron và những đặc thù chất hóa học tuần trả của bọn chúng.
Bạn đang xem: Bảng tuần hoàn hóa học lớp 7
Bảng yếu tắc chất hóa học lớp 7 - IUPAC là tư liệu hữu ích dành riêng cho chúng ta học viên đem ước muốn học tập nằm trong hóa trị nhằm rất có thể phần mềm mang đến quy trình thực hiện bài bác tập luyện trở thành đơn giản và dễ dàng và hiệu suất cao rộng lớn. Bảng tuần trả những yếu tắc chất hóa học mang đến tất cả chúng ta biết địa điểm của yếu tắc tao rất có thể suy luận kết cấu nguyên vẹn tử và đặc thù của yếu tắc. Chỉ cần thiết xác lập được địa điểm thì tất cả chúng ta cũng rất có thể đối chiếu nó với những loại yếu tắc không giống ngay sát kề. Vậy bên dưới đấy là bảng tuần trả lớp 7 công tác mới nhất chào chúng ta nằm trong theo gót dõi. Ngoài ra chúng ta coi tăng Cách gọi thương hiệu những ăn ý hóa học cơ học.
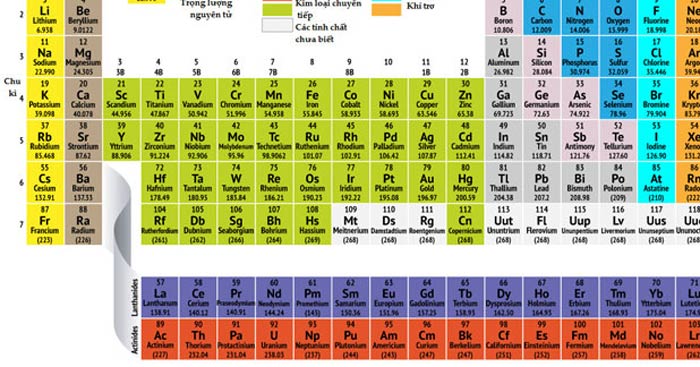
Nguyên tắc bố trí những yếu tắc hóa học
- Năm 1869, căn nhà chưng học tập người Nga D. I. Mendeleev vẫn xây cất bảng tuần trả theo hướng tăng dần dần lượng nguyên vẹn tử.
- Các căn nhà khoa học tập tân tiến vẫn minh chứng rằng năng lượng điện phân tử nhân nguyên vẹn tử mới nhất là hạ tầng nhằm xây cất bảng tuần trả.
- Hiện ni, bảng tuần trả những yếu tắc hoá học tập bao gồm 118 yếu tắc được xây cất theo gót nguyên lý sau:
- Các yếu tắc chất hóa học được bố trí theo hướng tăng dần dần của năng lượng điện phân tử nhân.
- Các yếu tắc chất hóa học nhập và một sản phẩm đem nằm trong số lớp electron nhập nguyên vẹn tử.
- Các yếu tắc chất hóa học nhập và một cột đem đặc thù chất hóa học tương tự nhau.
Bảng yếu tắc hóa học
| Số hiệu nguyên vẹn tử (Z) | Tên cũ | Tên yếu tắc chất hóa học (IUPAC) | Kí hiệu hoá học | Khối lượng yếu tắc (amu) | Hoá trị |
| 1 | Hiđro | Hydrogen | H | 1 | I |
| 2 | Heli | Helium | He | 4 | |
| 3 | Liti | Lithium | Li | 7 | I |
| 4 | Beri | Beryllium | Be | 9 | II |
| 5 | Bo | Boron | Bo | 11 | III |
| 6 | Cacbon | Carbon | C | 12 | IV, II |
| 7 | Nitơ | Nitrogen | N | 14 | II, III, IV… |
| 8 | Oxi | Oxygen | O | 16 | II |
| 9 | Flo | Flourine | F | 19 | I |
| 10 | Neon | Neon | Ne | trăng tròn | |
| 11 | Natri | Sodium | Na | 23 | I |
| 12 | Magie | Magnesium | Mg | 24 | II |
| 13 | Nhôm | Aluminium | Al | 27 | III |
| 14 | Silic | Silicon | Si | 28 | IV |
| 15 | Photpho | Phosphorus | P.. | 31 | III, V |
| 16 | Lưu huỳnh | Sulfur | S | 32 | II, IV, VI |
| 17 | Clo | Chlorine | Cl | 35,5 | I,… |
| 18 | Agon | Argon | Ar | 39,9 | |
| 19 | Kali | Potassium | K | 39 | I |
| 20 | Canxi | Calcium | Ca | 40 | II |
Chú thích:
- Nguyên tố phi kim: chữ color xanh
- Nguyên tố kim loại: chữ color đen
- Nguyên tố khí hiếm: chữ color đỏ
Bảng tuần trả những yếu tắc Hóa học tập lớp 7
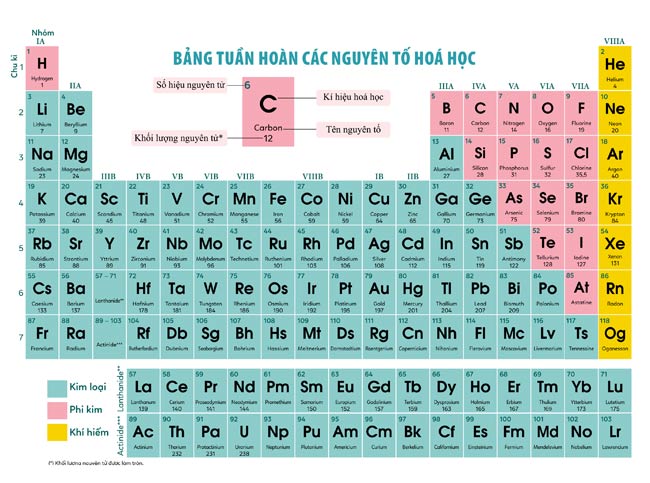
Bảng phiên âm tên thường gọi của trăng tròn yếu tắc chất hóa học đầu
Số hiệu nguyên vẹn tử (Z) | Kí hiệu hóa học | Tên yếu tắc hóa học | Phiên âm Quốc tế |
1 | H | Hydrogen | /ˈhaɪdrədʒən/ |
2 | He | Helium | /ˈhiːliəm/ |
3 | Li | Lithium | /ˈlɪθiəm/ |
4 | Be | Beryllium | /bəˈrɪliəm/ |
5 | B | Boron | /ˈbɔːrɒn/ /ˈbɔːrɑːn/ |
6 | C | Carbon | /ˈkɑːbən/ /ˈkɑːrbən/ |
7 | N | Nitrogen | /ˈnaɪtrədʒən/ |
8 | O | Oxygen | /ˈɒksɪdʒən/ /ˈɑːksɪdʒən/ |
9 | F | Fluorine | /ˈflɔːriːn/ /ˈflʊəriːn/ /ˈflɔːriːn/ /ˈflʊriːn/ |
10 Xem thêm: Công cơ học là gì? Công thức tính Công cơ học và Bài tập vận dụng - Vật lý 8 bài 13 | Ne | Neon | /ˈniːɒn/ /ˈniːɑːn/ |
11 | Na | Sodium | /ˈsəʊdiəm/ |
12 | Mg | Magnesium | /mæɡˈniːziəm/ |
13 | Al | Aluminium | /ˌæljəˈmɪniəm/ /ˌæləˈmɪniəm/ /ˌæljəˈmɪniəm/ /ˌæləˈmɪniəm/ |
14 | Si | Silicon | /ˈsɪlɪkən/ |
15 | P | Phosphorus | /ˈfɒsfərəs/ /ˈfɑːsfərəs/ |
16 | S | Sulfur | /ˈsʌlfə(r)/ /ˈsʌlfər/ |
17 | Cl | Chlorine | /ˈklɔːriːn/ |
18 | Ar | Argon | /ˈɑːɡɒn/ /ˈɑːrɡɑːn/ |
19 | K | Potassium | /pəˈtæsiəm/ |
20 | Ca | Calcium | /ˈkælsiəm/ |
Bài ca hóa trị hoặc, dễ dàng học tập nhất
Bài ca hóa trị 1
Xem thêm: Cơ năng là gì? Định luật bảo toàn cơ năng [Đầy đủ]
Kali (K), Iot (I), Hidrô (H)
Natri (Na) với Bạc Tình (Ag), Clo (Cl) một loài
Là hoá trị I hỡi ai
Nhớ ghi mang đến kỹ ngoài hoài phân vân
Magiê (Mg), Kẽm (Zn) với Thuỷ Ngân
(Hg)
Oxi (O), Đồng (Cu), Thiếc(Sn) tăng phần
Bari (Ba) Cuối nằm trong thêm
chú Canxi (Ca)
Hoá trị II ghi nhớ đem gì khó khăn khăn
Bác Nhôm (Al) hoá trị III lần
In thâm thúy trí ghi nhớ khi cần phải có ngay
Cacbon (C), Silic (Si) này đây
Có hoá trị IV ko ngày nào là quên
Sắt (Fe) tê liệt lắm khi hoặc phiền
II, III tăng lên và giảm xuống ghi nhớ ngay tắp lự tức thì thôi
Nitơ (N) phiền nhiễu nhất đời
I, II, III, IV khi thời lên V
Lưu huỳnh (S) lắm khi đùa khăm
Xuống II lên VI khi ở loại IV
Phot pho (P) nói đến việc ko dư
Có ai căn vặn cho tới thì ừ rằng V
Em ơi, nỗ lực học tập chăm
Bài ca hoá trị xuyên suốt năm nhớ dùng.
Bài ca hóa trị 2
Hidro (H) cùng theo với liti (Li)
Natri (Na) cùng theo với kali (K) chẳng rời
Ngoài rời khỏi còn bạc (Ag) sáng sủa ngời
Chỉ đem hoá trị I thôi chớ nhầm
Riêng đồng (Cu) cùng theo với thuỷ ngân (Hg)
Thường II không nhiều I chớ lưỡng lự gì
Đổi thay cho II , IV là chì (Pb)
Điển hình hoá trị của chì là II
Bao giờ nằm trong hoá trị II
Là ôxi (O) , kẽm(Zn) chẳng sai chút gì
Ngoài rời khỏi còn tồn tại can xi (Ca)
Magiê (Mg) cùng theo với bari (Ba) một nhà
Bo (B) , nhôm (Al) thì hóa trị III
Cacbon (Ca) Silic (Si) thiếc (Sn) là IV thôi
Thế tuy nhiên nên trình bày tăng lời
Hóa trị II vẫn chính là điểm chuồn về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ dàng phát triển thành ngay tắp lự Fe III
Phốtpho III không nhiều gặp gỡ mà
Photpho V chủ yếu người tao gặp gỡ nhiều
Nitơ (N) hoá trị từng nào ?
I , II, III , IV phần nhiều cho tới V
Lưu huynh lắm khi đùa khăm
Khi II khi IV , VI tăng tột cùng
Clo Iot lung tung
II III V VII thông thường thì I thôi
Mangan phiền nhiễu nhất đời
Đổi kể từ I cho tới VII thời mới nhất yên
Hoá trị II sử dụng cực kỳ nhiều Hidro (H) cùng theo với liti (Li)
Natri (Na) cùng theo với kali (K) chẳng rời
Ngoài rời khỏi còn bạc (Ag) sáng sủa ngời
Chỉ đem hoá trị I thôi chớ nhầm
Riêng đồng (Cu) cùng theo với thuỷ ngân (Hg)
Thường II không nhiều I chớ lưỡng lự gì
Đổi thay cho II , IV là chì (Pb)
Điển hình hoá trị của chì là II
Bao giờ nằm trong hoá trị II
Là ôxi (O) , kẽm(Zn) chẳng sai chút gì
Ngoài rời khỏi còn tồn tại can xi (Ca)
Magiê (Mg) cùng theo với bari (Ba) một nhà
Bo (B) , nhôm (Al) thì hóa trị III
Cacbon (Ca) Silic (Si) thiếc (Sn) là IV thôi
Thế tuy nhiên nên trình bày tăng lời
Hóa trị II vẫn chính là điểm chuồn về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ dàng phát triển thành ngay tắp lự Fe III
Phốtpho III không nhiều gặp gỡ mà
Photpho V chủ yếu người tao gặp gỡ nhiều
Nitơ (N) hoá trị từng nào ?
I , II, III , IV phần nhiều cho tới V
Lưu huynh lắm khi đùa khăm
Khi II khi IV , VI tăng tột cùng
Clo Iot lung tung
II III V VII thông thường thì I thô
Hoá trị VII cũng khá được yêu thương hoặc cần
Bài ca hoá trị nằm trong lòng
Viết thông công thức dự phòng lãng quên
Học hành nỗ lực cần thiết chuyên
Siêng ôn chuyên nghiệp luyện tất yếu ghi nhớ nhiều

