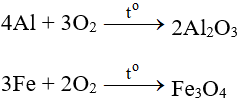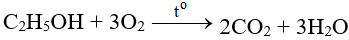Tailieumoi.vn van nài ra mắt phương trình 4FeO + O2 → 2Fe2O3 bao gồm ĐK phản xạ, cơ hội triển khai, hiện tượng lạ phản xạ và một trong những bài bác tập luyện tương quan hùn những em gia tăng toàn cỗ kỹ năng và kiến thức và tập luyện kĩ năng thực hiện bài bác tập luyện về phương trình phản xạ chất hóa học của Sắt. Mời chúng ta đón xem:
Phương trình 4FeO + O2 → 2Fe2O3
Bạn đang xem: FeO + O2 → Fe2O3 | FeO ra Fe2O3
1. Phương trình phản xạ hóa học:
4FeO + O2 → 2Fe2O3
2. Hiện tượng nhận thấy phản ứng
- Chất rắn FeO black color gửi sang trọng red color nâu
3. Điều khiếu nại phản ứng
- Nhiệt độ
4. Tính hóa học hoá học
4.1. Tính hóa học hoá học tập của FeO
- Mang tương đối đầy đủ đặc thù chất hóa học của oxit bazo.
- Là hóa học vừa phải đem tính lão hóa, vừa phải đem tính khử
Tính oxit bazơ
FeO tính năng với hỗn hợp axit: HCl, H2SO2 loãng
FeO + 2HCl → FeCl2 + H2
FeO + H2SO4 loãng → FeSO4 + H2O
Tính oxi hóa
- Tác dụng với hóa học khử như H2, CO, Al, C…
FeO + H2 → Fe + H2O
FeO + CO → Fe + CO2
3FeO + 2Al → Al2O3 + 3Fe
Tính khử
- FeO là hóa học khử Lúc tính năng với những hóa học đem tính lão hóa mạnh:
3FeO + 10HNO3 loãng → 3Fe(NO3)3 + NO + 5H2O
2FeO + 4H2SO4 (đặc) → Fe2(SO4)3 + SO2 + 4H2O
4.2. Tính hóa học hoá học tập của O2
Khi nhập cuộc phản xạ, nguyên vẹn tử O đơn giản nhận thêm thắt 2e. Nguyên tử oxi có tính âm năng lượng điện rộng lớn (3,44), chỉ xoàng xĩnh flo (3,98).
Do vậy, oxi là yếu tố phi kim sinh hoạt hoá học tập, đem tính oxi hoá mạnh. Trong những ăn ý hóa học (trừ ăn ý hóa học với flo), yếu tố oxi đem số oxi hoá là -2.
Oxi tính năng với đa số những sắt kẽm kim loại (trừ Au, Pt, ...) và những phi kim (trừ halogen). Oxi tính năng với rất nhiều ăn ý hóa học vô sinh và cơ học.
Tác dụng với kim loại
Tác dụng với đa số sắt kẽm kim loại (trừ au và Pt), cần phải có to tạo oxit:
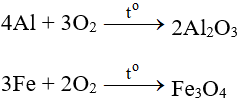
Tác dụng với phi kim
Tác dụng với đa số phi kim (trừ halogen), cần phải có to tạo oxit:
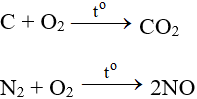
ĐB: Tác dụng với H2 nổ mạnh theo đòi tỉ lệ thành phần 2:1 về số mol:
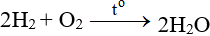
Tác dụng với ăn ý chất
- Tác dụng với những hóa học đem tính khử:
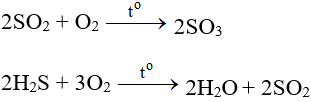
Xem thêm: Âm đạo nổi mụn thịt là bị làm sao? Cách chữa trị
- Tác dụng với những hóa học hữu cơ:
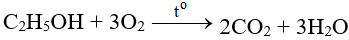
5. Cách triển khai phản ứng
- Cho FeO tính năng với oxi
6. Bài tập luyện liên quan
Ví dụ 1: Quặng này tại đây nhiều Fe nhất?
A. Pirit Fe FeS2.
B. Hematit đỏ loét Fe2O3.
C. Manhetit Fe3O4
D. Xiđerit FeCO3
Hướng dẫn giải
Quặng nhiều Fe nhất là manhetit Fe3O4 với dung lượng Fe khoảng chừng 72,4%
Đáp án : C
Ví dụ 2: Cho những cặp lão hóa – khử được bố trí theo hướng tăng dần dần tính lão hóa của dạng lão hóa như sau: Fe2+/Fe, Cu2+/Cu, Fe3+/Fe2+. Phát biểu này sau đấy là đúng?
A. Cu2+ oxi hóa được Fe2+ thành Fe3+.
B. Fe3+ oxi hóa được Cu trở nên Cu2+.
C. Cu khử được Fe3+ thành Fe.
D. Fe2+ oxi hóa được Cu trở nên Cu2+.
Hướng dẫn giải
A sai vì thế Cu2+ không lão hóa được Fe2+ thành Fe3+.
C sai vì thế Cu chỉ khử được Fe3+ thành Fe2+.
D sai vì thế Fe2+ không lão hóa Cu trở nên Cu2+.
Đáp án : B
Ví dụ 3: Ở ĐK thông thường Fe phản xạ với hỗn hợp này sau đây:
A. FeCl3.
B. ZnCl2.
C. NaCl.
D. MgCl2.
Hướng dẫn giải
Fe + 2FeCl3 → 3FeCl2
Đáp án : A
7. Một số phương trình phản xạ hoá học tập không giống của Sắt (Fe) và ăn ý chất:
6FeO + O2 → 2Fe3O4
FeO + C → CO↑ + Fe
FeO + H2 → Fe + H2O
5FeO + 2P → 5Fe + P2O5
Xem thêm: Trắc nghiệm Tin học 11 Kết nối tri thức Bài 12: Hệ quản trị cơ sở dữ liệu và hệ cơ sở dữ liệu
FeO + CO → Fe + CO2↑
3FeO + 2NH3 → 3Fe + 3H2O + N2↑
FeO + H2S → FeS↓ + H2O